「化学教育ジャーナル(CEJ)」第12巻第2号(通巻23号)発行2009年12月28日/採録番号12-6/2009年4月9日受理,5月25日修正
URL = http://chem.sci.utsunomiya-u.ac.jp/cejrnl.html
教材開発
セルロースを利用したバイオエタノール学習の教材化
Development of the Apparatus for Cellulosic Bio-Ethanol learning and Establishment of Its Procedure.
川村 幸嗣1,*, 本間 弘明1, 岩崎 禎1, 谷生 重晴2(1光明理化学工業(株),2横浜国立大学 環境情報学府)
Koji KAWAMURA1,*, Hiroaki HONMA1, Tadashi IWASAKI1, Shigeharu TANISHO2 (1Komyo Rikagaku Kogyo, 2Graduate school of Environment and Information Science, Yokohama National University)
*kawamura@komyokk.co.jp
1 はじめに
石油などの化石燃料の消費は大気中の二酸化炭素量を増加させ、地球温暖化を引き起こすとされている。このため、近年カーボンニュートラル効果が得られることから、石油代替エネルギー源としてバイオマスを利用する方法が注目されている1)。なかでも発酵により得られるバイオエタノールをエネルギー源として利用する方法は、既存のインフラが利用できる等の利点があることから現在実用化が進められている2)。しかしながら食糧危機に関する問題が叫ばれている今日、デンプンやサトウキビ等の食糧を用いたバイオエタノール燃料の製造には問題が多い。これより近年では食糧とならない木材や草本、廃棄紙由来のセルロースを用いたエタノール製造技術の確立が求められている3)。
一方、教育現場においても環境問題に対する関心は高く、エネルギー問題が取り上げられる機会は多い4)。酵母を用いたアルコール発酵に関する授業が行われることもある。しかし、発酵の程度の確認は容易でなく「キューネ氏発酵管を利用した生成二酸化炭素量を確認する」という手法がとられている。この方法は操作が煩雑で試験溶液を手で触らなければならないなどの欠点がある。また、セルロース系化合物からバイオエタノールを製造するという原理を実験的に確認できる教材は見あたらない。
そこで筆者らは、セルラーゼとセルロースろ紙、酵母、ガス検知管を用いて、教室で教師および生徒がセルロース由来バイオエタノールに関する実験ができる学習教材の開発を実施した。すなわち、セルロースろ紙をセルラーゼにてグルコースへと分解し、これを酵母によりアルコール発酵させ、生成する二酸化炭素及びエタノールガス濃度を検知管で測定するという手法である。
本報では開発教材の実験条件や検討結果について示す。
2 開発した実験教材の概要
セルロースろ紙をセルラーゼによって分解させ、得られるグルコースから酵母を用いてアルコール発酵を行う。アルコール発酵は検知管を用いた二酸化炭素およびエタノールガス濃度の測定から確認する。これにより、紙がバイオマスであることを学習させる。ろ紙の分解時間は24〜70時間程度。24時間以上であれば試験可能であるが、授業の時間割によっては翌日実験できない場合もあるため24〜70時間と幅を持たせた。発酵実験に必要な時間は約2時間。
3 材料および実験方法
実験条件は注記しない限り以下の条件を基本としている。
- セルロースろ紙量:6g / 60 mL
(アドバンテック社No.5C 185Φmm 2枚未満)
- セルラーゼ量:0.05 g / 60 mL (1000 unit / 60 mL)
- 培養液量 60 mL ・酵母量:0.3 g / 60 mL
- セルロース分解および培養温度:40℃(恒温槽)
- セルロース分解時間(処理時間):35時間
- アルコール発酵時間:2時間
- 容器:100 mL容のプラスチック容器と、シリコーン製フタに2箇所穴を開け、テフロンチューブ(内径4mmΦ)を差し込んだ発酵用キャップ。セルラーゼ処理時にはフタを閉めた状態で(図1の左写真)、発酵時には発酵用キャップを差し込んで(図1の右写真)試験した。
- 二酸化炭素濃度測定: 光明理化学工業社 二酸化炭素検知管(BCO2型) ガス採取量は50 mL
- エタノールガス濃度測定:光明理化学工業社 エタノール検知管 (BEtOH型) ガス採取量は100 mL
- 糖類の分析:グルコース量はヘキソキナーゼおよびグルコース6リン酸脱水素酵素による吸光光度計を用いた酵素法(F-kit ロシュ社)にて分析した。フルクトース量に関しても、グルコースホスフェートイソメラーゼ、へキソキナーゼおよびグルコース6リン酸脱水素酵素による酵素法(F-kit ロシュ社)により測定した。
- エタノールの分析:エタノール量はアルコール脱水素酵素による酵素法(F-kit ロシュ社)にて分析した。

なお、ろ紙ははさみで0.5〜1cm角程度の大きさに裁断してから試験に供した。
3.1 セルラーゼによるセルロースろ紙分解試験
セルラーゼには粉末状の酵素A(Trichoderma viride由来 至適pH 4〜5、至適温度40〜55℃ 20000 unit / g、ヤクルト薬品工業社、10800円 / 10g)、酵素B(T. viride由来 至適pH 4.5、至適温度45℃ 280unit / g、アマノエンザイム社、16800円 / kg)、および溶液状の酵素C(Aspergillus sp.由来 至適pH 6〜10、至適温度60℃ 1000 unit / mL、シグマ アルドリッチ社、9270円 / 50mL)の3種を候補として選定した。酵素活性はセルロース処理後ろ紙をいれた溶液中のグルコース濃度を測定して確認した。また酵素には賦形剤としてグルコース等の糖質が含まれている場合があることから、これらの酵素にグルコースが含まれているかについても確認した。セルラーゼ処理後ろ紙の入った溶液に酵母(Saccharomyces cerevisiae 日清フーズ社 ドライイースト 細胞数 100億個 / g)を投入し、アルコール発酵試験を実施した。発酵後の容器内のヘッドスペースガスの二酸化炭素およびエタノールガス濃度を検知管にて測定した(図1)。
3.2 セルラーゼおよびろ紙量の検討
セルラーゼが0、0.05、0.3 g / 60 mLの量にてろ紙分解試験を実施し、得られるグルコースの量からセルラーゼの必要な量を検討した。なお、0.3 g / 60 mLの試験区においてはろ紙の量は12 g / 60 mLの条件で試験した。処理時間は0.05 g / 60 mLの条件で24時間、0.3 g / 60 mLの条件で18時間である。
またろ紙の量が0、1、3、6 g / 60 mLの割合にてセルラーゼによる分解試験を実施し、至適なろ紙の量を検討した。なおセルラーゼの処理時間は24時間である。
3.3 ブランクでの発酵試験
酵母を0、0.3、1、4 g / 20 mLの条件で糖質を与えずに発酵させた。この時のヘッドスペースガス中の二酸化炭素濃度を測定することで、ブランクで得られる二酸化炭素濃度と酵母の量の関係について確認した。この試験においては、発酵時間は1時間の条件にて実施した。
3.4 セルラーゼ長期保管試験
セルラーゼはゼラチンカプセル(松屋社 局方品 000号、788円 / 100個)に入れて保管し、試験時にカプセルを開けて溶液に投入することとした(図2)。これはセルラーゼが高価であり、少量しか教材に含ませることができないため、実験一回分の必要量をカプセルに封入して教材化したためである。

この状態、すなわち0.05 gのセルラーゼをカプセルにいれた条件にて酵素の保管試験を実施した。この試験は酵素がカプセルの形状で長期保管できる方が配布や流通がしやすく、教材として望ましいために実施した。50℃の条件にカプセルを保管して加速試験を実施し、常温換算で14ヶ月間セルラーゼが失活するかについて確認した。なお50℃における保管4日間は常温換算にて1週間に相当する。酵素活性はセルロースろ紙分解により得られるグルコース量から確認した。
3.5 使い捨てカイロを用いた実験
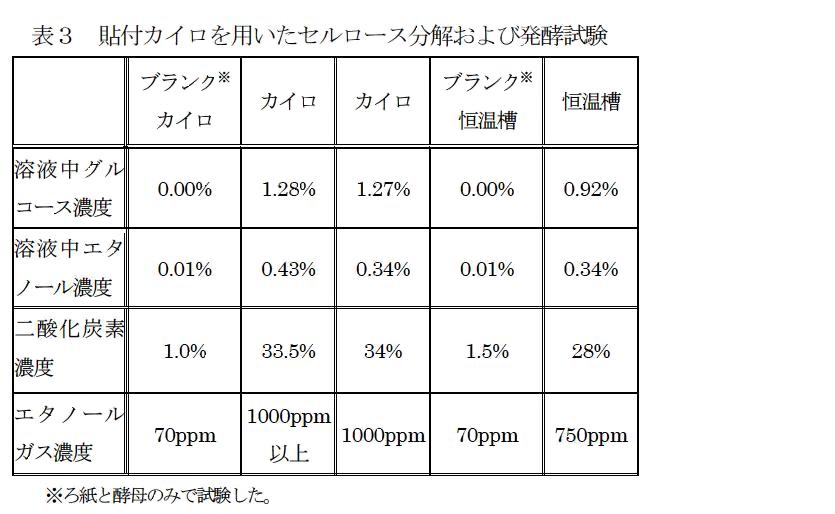
本教材では、セルラーゼ処理時および発酵時における加熱には、恒温槽を用いて実施している。しかしながら、恒温槽は教材用のものでも比較的高価(4〜5万円程度)であるため、学校によっては所有していない場合がある。このため加温時に貼付けタイプの使い捨てカイロ(貼るホッカイロ 130×95 mm 白元社 最高温度63℃、平均温度53℃、40℃以上の保持時間12時間以上 2枚)を容器に貼付する方法でも実験可能か確認した。
3.6 開封後酵母の長期保管試験
酵母はアルミヒートシールに封入された状態で販売されているものを用いたが、このシール開封後における酵母の保管可能期間について確認した。これは酵母が開封後でも長期保管可能で、何度も使用できるほうが教材として望ましいことから確認した。アルミヒートシールを開封後冷蔵庫にて3および6ヶ月間保管した酵母をグルコース溶液(0.6 g/ 60 mL)に0.3 g投入し、アルコール発酵するかについて確認した。
3.7 セルロースろ紙以外の基質分解試験
セルロースろ紙の代わりに、段ボール、シュレッダー裁断紙(印字されたコピー紙が原料)、割り箸をそれぞれ6 g基質としてセルラーゼに作用させ、セルロースろ紙と同様に実験できるかについて確認した。段ボールはろ紙の場合と同様に裁断し、割り箸は適当に粉砕してから試験に供した。シュレッダー裁断紙はそれ以上裁断せずに使用した。結果は得られる溶液中のグルコース、エタノール濃度およびヘッドスペースガスの濃度から確認した。
4 結果および考察
4.1 セルラーゼでのセルロースろ紙分解試験
結果を表1に示す。酵素Bには高濃度(15.5%)のグルコースが含まれていた。酵素Bには賦形剤としてデキストリンが使用されていたが、この中に不純物としてグルコースが含まれていたと思われる。このため酵素Bを用いた場合、分解試験前でもすでに溶液中のグルコースの濃度は3.8 %と高く、セルラーゼ処理により得られるグルコース濃度(0.3%)の10倍以上であった。すなわち、酵素Bのようなセルラーゼを用いた場合はブランクとして含まれるグルコース量が多く、ブランク値が高くなりすぎてセルラーゼにより得られるグルコースを確認することは困難である。一方酵素AおよびCにおいては、グルコースは含まれておらず、セルロース分解によりそれぞれ0.81および0.15 %のグルコースが得られたため、酵素AおよびCを候補として用いることにした。セルラーゼには酵素Bの様に糖質が賦形剤として含まれていることがあり、酵素の製品情報には記載されていない場合もある。本実験のようにセルラーゼを用いた試験を実施する場合には、酵素中にブランクとしてグルコースが含まれていないことを予備実験によって確認しておくことが重要である。
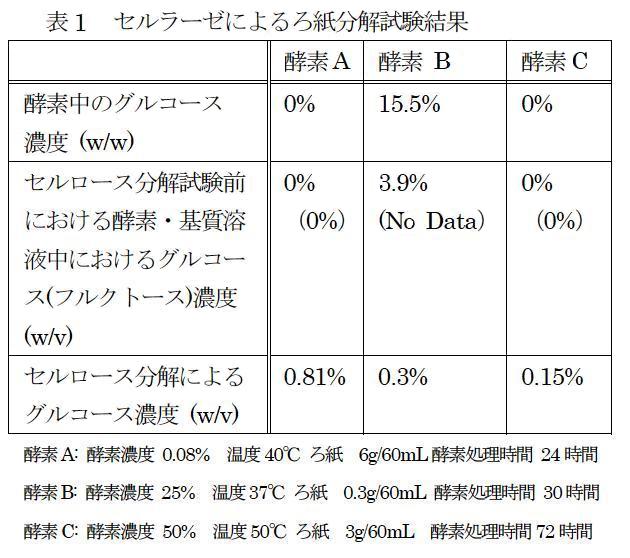
図3に酵素AおよびCでのセルロース分解試験結果を示した。酵素Aで得られるグルコース濃度は、酵素Cに比べて著しく高かった。さらに処理温度は酵素Aでは40℃と低く、50℃での加温を実施した酵素Cに比べて試験しやすかった(酵素Cの至適温度は60℃である)。
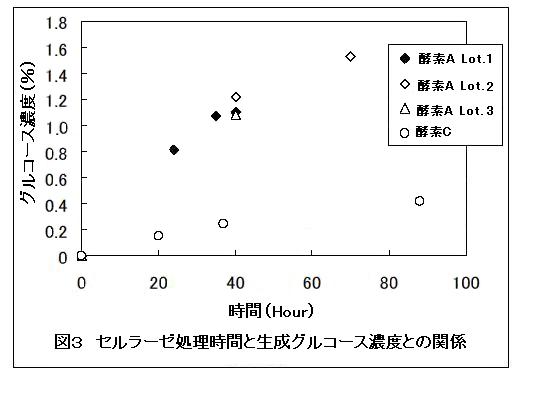
また表2には酵素AおよびCにより得られた溶液での発酵試験結果を示した。酵素Aは酵素Cに比べて、短時間の処理時間でより高い濃度の二酸化炭素およびエタノールガス濃度を得ることができ、ブランクとの差がより明白であった。さらに酵素Aの使用セルラーゼ1回分あたりの価格は酵素Cに比べて20分の1程度であり、安価であることからも教材化においては利点が高い。これらの結果から本教材に使用するセルラーゼは酵素Aを用いることとした。以下より、酵素Aはセルラーゼと表記する。
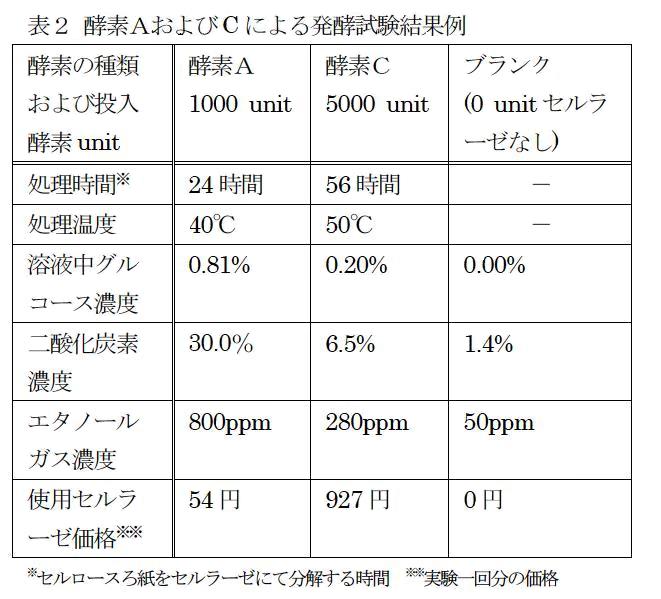
4.2 セルラーゼおよびろ紙量の検討
図4にセルラーゼの量に関する検討結果を示した。
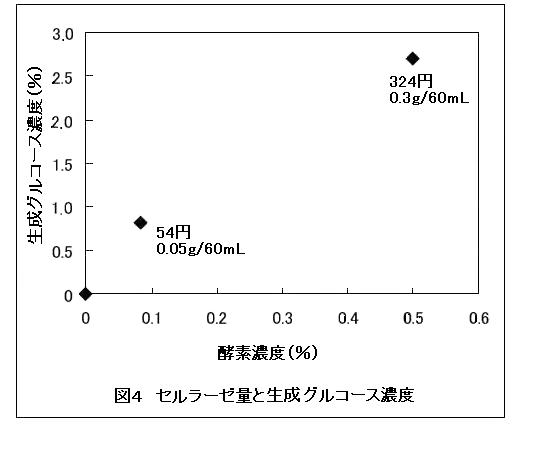
表2に示した様に、本方法においてはグルコースが1%程度の濃度であれば、高濃度の二酸化炭素およびエタノールガスを得ることができる。教材を安価にするためには、使用するセルラーゼの量は少ない方がよい。このため0.05gの量でも十分糖化できたため、教材の一回あたりの酵素使用量は0.05 gとした。
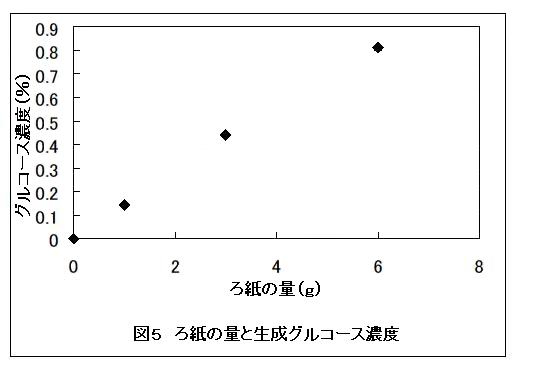
またろ紙の量と得られるグルコース量や発酵試験の結果を図5に示した。その結果、得られるグルコースの濃度は、ろ紙の量が多いほど高かった。なお6 g以上のろ紙は量が多くなりすぎ、取扱が不便であった。これより教材において使用するろ紙の量は1〜6 gとした。
4.3 ブランクでの発酵試験
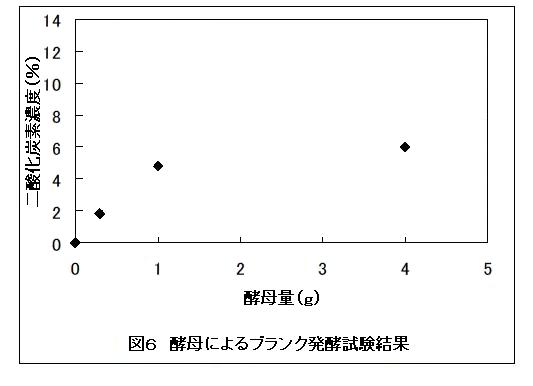
図6には糖質が無い条件におけるブランク発酵での二酸化炭素濃度と酵母量との関係について示した。本教材では糖質が無い条件でも、生きている酵母を容器内に投入するため、ある程度酵母の呼吸により排出される二酸化炭素がブランク値として検出される。
このブランク発酵は、投入酵母量が多いほど多くなる傾向がある。このため、投入する酵母はできるだけ少なくすることとした。図6では酵母量が0.3 gの条件でブランク発酵にて得られる二酸化炭素濃度は2%以下である。
この結果を参考とし、本教材で使用する酵母の量は0.3 g / 60 mLにした。なお、この酵母量においてはブランクの二酸化炭素は少なく、アルコール発酵は十分に行うことができる(発酵の例としては、表2の酵素Aおよびブランクの結果参照)。
4.4 セルラーゼ長期保管試験
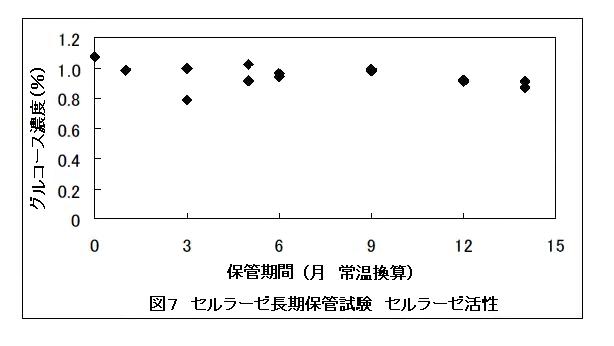
セルラーゼ長期保管試験の結果を図7に示した。セルラーゼは常温換算で14ヶ月の間活性がほとんど低下しなかった。また、保管後のセルラーゼを用いて発酵試験を実施したところ、エタノールが生成され、検知管による二酸化炭素およびエタノールガスも確認できている(Data not shown)。
これらの結果から、教材に使用するカプセルに封入したセルラーゼは一年以上保管可能であることが確認できた。
4.5 開封後酵母の長期保管試験
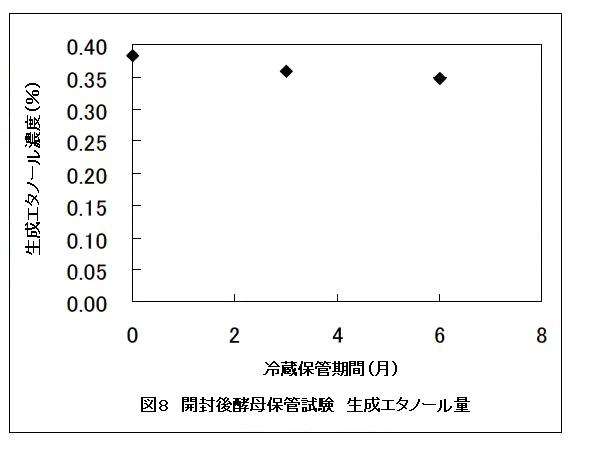
開封後3, 6ヶ月間冷蔵保管した酵素でも、アルコール発酵を行うことが確認され(図8)、また検知管により確認される二酸化炭素およびエタノールガスの濃度は保管後においてもほとんど低下しなかった(Data not shown)。これより、酵母は開封後でも6ヶ月は実験可能で、教材として都合がよい。
4.6 発酵試験の結果
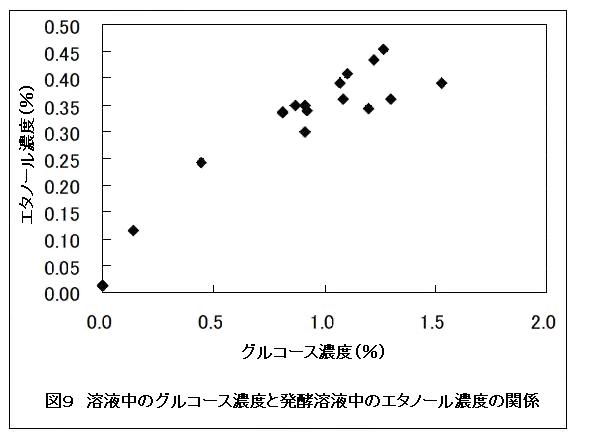
図9には、ろ紙より得られたグルコース溶液の濃度と、その後に発酵して得られるアルコール濃度との関係を示した。溶液中のグルコース濃度が高いほど、発酵により得られるアルコール濃度は高かった。なお理論上1%のグルコース溶液が完全にアルコール発酵の基質に利用された場合は、0.514%のエタノール溶液を得ることができる。本試験では1%程度のグルコース溶液を用いたところ0.3〜0.4%のエタノールが得られているため、グルコースからエタノールへの変換率は、理想的な条件の60〜80%程度である。
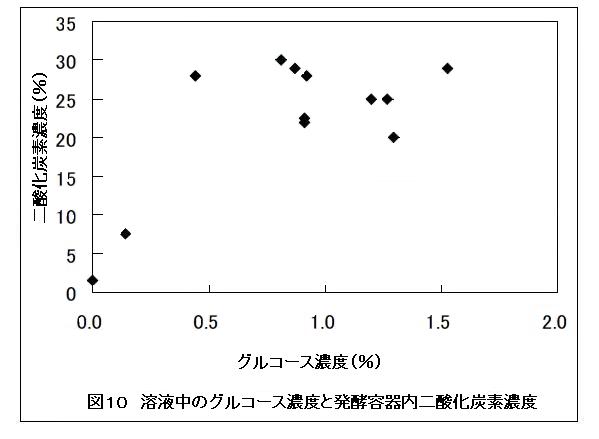
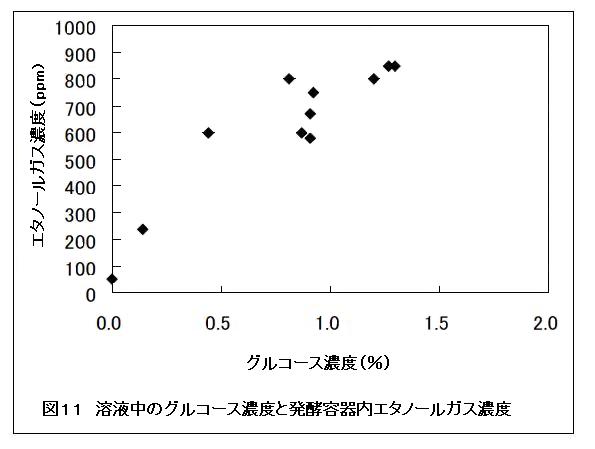
発酵後の容器内ヘッドスペースの二酸化炭素およびエタノールガス濃度を検知管で測定したところ、溶液中のグルコースおよびエタノール量が高いほど、測定値も高くなる傾向にあった(図10および11)。これより、ヘッドスペースの二酸化炭素およびエタノールガス濃度を測定することで、容器内のアルコール発酵を確認できることが分かった。アルコール発酵にはグルコースなどの糖質が必要であるため、本方法にてセルロースがセルラーゼによりグルコースに変換されていたことを間接的に確認できる。
4.7 使い捨てカイロ加温での試験
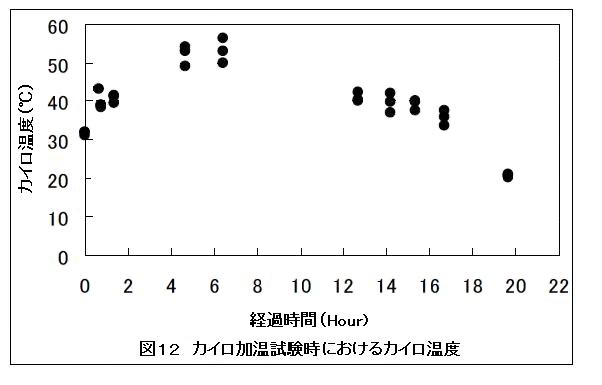
図12には、セルラーゼ処理時におけるカイロの温度を熱電対式の温度センサで測定した結果を示した。温度はカイロと容器の間に熱電対式温度センサを差し込むことで測定した。試験時における室温・湿度はそれぞれ18.2〜24.9および21〜29%RHであった。カイロの温度は、カイロの仕様書通り40℃以上を12時間持続していた。
また、カイロによるセルラーゼ処理および発酵試験の結果を表3に示した。その結果、カイロを使用した場合でも、恒温槽の結果と同等以上のグルコース濃度、二酸化炭素およびエタノールガス濃度を得ることができた。このように、恒温槽を有していない学校施設においても、安価な使い捨てカイロを用いることで実験できる。
4.8 セルロースろ紙以外の基質分解試験
段ボールおよびシュレッダー裁断紙ではアルコール発酵していることが確認され、得られる濃度は低いものの、二酸化炭素およびエタノールガスが検出された(表4)。なおシュレッダー裁断紙ではグルコースの分析を酵素法にて行ったが、吸光度はほとんど上昇しなかった。しかし、実験中にはろ紙の試験結果と同様にシュレッダー裁断紙は崩壊していき、さらにアルコール発酵も確認されたことから、シュレッダー裁断紙はセルラーゼにより分解され、グルコースが生成されていたと推察される。吸光度が上昇しなかったのは、グルコースが生成されていなかったのではなく『シュレッダー裁断紙中にふくまれるインクやコピー紙製造に使用される化学物質などが分析に影響を及ぼし、分析できなかったため』ではないかと思われる。
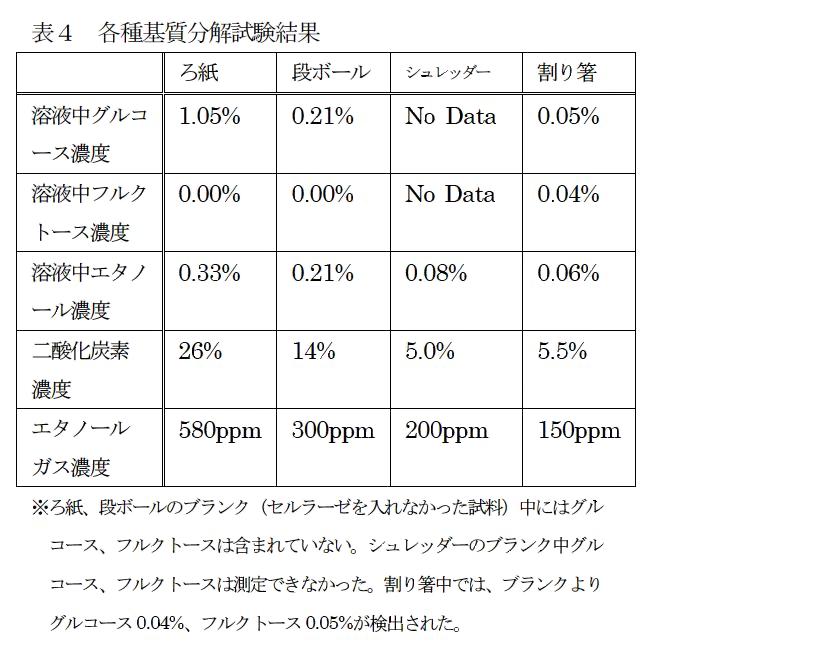
一方割り箸に関しても、アルコール発酵していることが確認され、二酸化炭素およびエタノールガスが検出された。しかし割り箸に関しては、セルラーゼを投入しなかったブランクの溶液からもグルコース、フルクトースが確認され、さらにその濃度はセルラーゼ処理後のものとほとんど差がみられなかった(表4下注釈参照)。
この結果から、割り箸に関してはセルロースがセルラー
ゼにより分解されてグルコースが生成されたのではなく、割り箸中にブランクとして含まれている糖質によりアルコール発酵していると思われる。割り箸は木材由来であるため、割り箸中にわずかに残存する樹液由来のグルコースおよびフルクトースにより発酵したと考えられる。この結果から、本教材では素材中にグルコースやフルクトースなどが予め含まれるバイオマスを基質として実験した場合、これらの糖質による発酵がみられるため、セルラーゼ由来のバイオマスとの区別は難しい。なお割り箸でセルラーゼによりセルロースが分解できなかったのは、木材にはヘミセルロースおよびリグニンが存在しており、紙等に比べて分解が困難であることによると思われる。
5 結 論
本実験方法によって、セルロースろ紙や紙をグルコースに分解し、かつアルコール発酵させることができた。発酵の確認は検知管を用いるだけで、誰でも簡易にセルロースがアルコール発酵の基質となること、すなわちバイオマスであることを学習することができる。生成エタノールの濃度は低いため、これを利用した発電や内燃機関の作動試験などは実施できないが、テキストなどを用いてエタノールがエネルギー資源であることを学習させ、バイオマスエネルギーに関する理解を深めることが可能となる。これまで紙などのセルロース系バイオマスからアルコール発酵に関する実験を実施し、その結果を検知管にて視覚的に確認できるような教材は存在しなかったため、本方法の手順をマニュアル化すれば、エネルギー教育の一環とすることができる。
なお本教材で使用した酵素、容器などの部材価格は10回程度分で数千円である。ガス検知管は10回分三千円程度、検知管用ガス採取器は二万円以下である。試験所要時間でみると、セルラーゼの分解に数十時間必要であるため、準備段階と発酵試験とで日を変えて試験する必要がある。
今後は本実験方法における教材としての導入方法や、教育効果について検証していきたい。
6 補 足
- 本実験で生成されるエタノール溶液の濃度は1%以下であり、飲料でないことから酒税法に抵触しない。
- 本実験でのセルロースの糖化率は試験条件にもよるが、基本条件で、1%のグルコース溶液が生成された場合は10%である。
- 本教材で、セルロース処理後のサンプル中にはグルコースとともに、分解しきれなかったろ紙も含まれる。このろ紙に還元性糖質に対して変色するベネジクト液を滴下し、加熱することで得られる色調の変化からグルコースの存在を確認することもできる。
参考文献
- 児玉徹, バイオマスエネルギー利用技術, CMC出版, 2006, 3-10.
- 木谷収, バイオマスは地球環境を救えるか, 岩波書店, 2007, 72-77.
- 坂西欣也, 澤山茂樹, 遠藤貴士, 美濃輪智朗, トコトンやさしいバイオエタノールの本, 日刊工業新聞社, 2008, 134-145.
- 東京書籍, 新編新しい科学, 1分野下, 科学技術と人間, 2008, 92-101.
 トップへ
トップへ  CEJ, v12n2目次へ
CEJ, v12n2目次へ
















