3.溶質ー溶質間相互作用
溶質と溶媒が2成分系混合液として存在するときには3種の相互作用(溶質ー溶質、溶質ー溶媒、溶媒ー溶媒)が存在する。しかし、溶質の濃度が純液体まで高まったときには溶質ー溶質相互作用のみが認められるので、純液体の分子間相互作用について以下に述べる。
沸点は液体分子を束縛から解き放つために必要なエネルギーを代表している。強い分子間力で引き合っている液体状態の分子を解き放ってばらばらの分子(蒸気)の状態にするためには、高い熱エネルギーを与える必要がある。沸点が低い液体分子は弱い相互作用によって結ばれているし、沸点の高い液体は強く引き合っている。従って、液体の沸点を系統的に調べると液体状態を保つために必要な分子間相互作用の寄与が把握できる。
そこで、鎖状有機化合物の標準沸点(1気圧下における沸点)とその有機化合物を構成する炭素の数の関係を図1に示した。図1において炭素数が増加すると飽和炭化水素(RH)の沸点は増加している。この傾向の主な原因は、炭素数の増大とともに分子表面積が増加して瞬時モーメントの発生する機会も増えるので分散引力が増加することにある。すなわち、鎖状飽和炭化水素(RH)では炭素数の増加とともに分散引力が強まるので沸点も増大する。
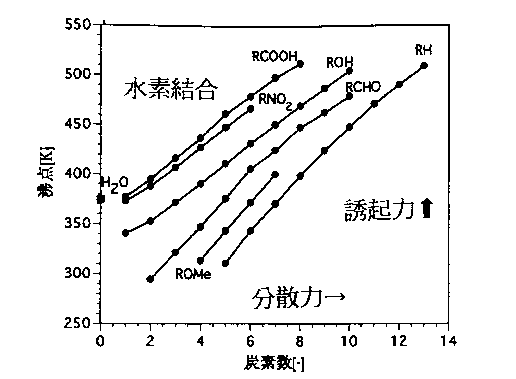
図1 有機溶媒の沸点と分子間相互作用の関係[1,2]
一方、ニトロ基のように分極状態
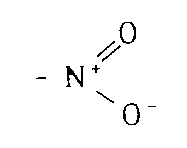
をとって永久双極子モーメントをもつ官能基が炭素鎖の末端に加わると隣接する分子の表面に発生する誘起双極子と永久双極子との間に引力が新たに発生する。この誘起力が前記の分散引力に加わった結果、分散力が単独に存在する場合よりも沸点は高まる。すなわち、沸点は炭素数のみならず末端の官能基の影響を強く受けて、官能基別にほぼ平行な炭素数ー沸点関係がえられることになる。誘起引力によって沸点を上昇させる置換基の強さの順番は以下のごとくである。
-COOH > -NO2 > -OH > -COOCH3,-CHO >-OCH3 > -H
図2に炭化水素の沸点と炭素数の関係を示す。沸点が高まる順は分子表面積の増加順
イソパラフィン<n−アルカン、アルケン、アルカジエン<芳香族<シクロアルカン
に対応していて、分散力が主体となる溶質ー溶質間相互作用もこの順に増大する。
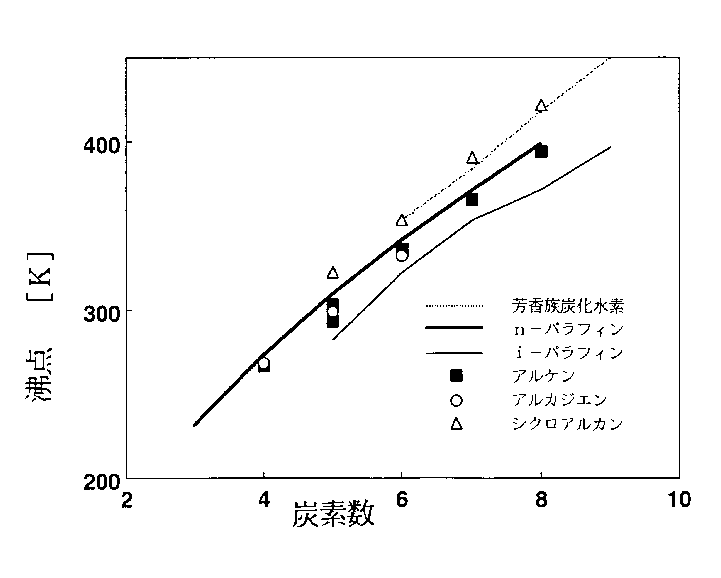
図2 炭化水素に対する沸点と炭素数の関係


