4.溶質ー溶媒間相互作用
4.1 水と有機溶媒の間の溶質移行エネルギー
溶質ー溶媒間相互作用を明らかにするためにはは溶質ー溶質間相互作用が存在しない条件を設定しなければならない。それは、溶質が溶媒の中に無限希釈状態で存在する場合である。このとき、溶質分子の回りには他の溶質分子は存在しないので溶質ー溶質間相互作用が無視できるわけである。
一つの溶媒の中に無限希釈状態で存在する溶質に対する分子間相互作用のエネルギーを、化学ポテンシャルの値で評価しようとしてしても、これを固有の値として定めることはできない。しかし、二つの溶媒が接していて溶質が無限希釈状態で平衡分配しているときのそれぞれの相における溶質の化学ポテンシャルの値の差は決定できる。例えば、水とヘプタンが接している2相にベンゼンを分配させて平衡が成り立っている場合に、水相中のベンゼンの化学ポテンシャルμi,aqとヘプタン相中のベンゼンの化学ポテンシャルμi,orgの差は次式によって表される[7]。
μi,org ー μi,aq = RT ln Pi (1)
ただし、Rは気体定数、Tは絶対温度、Piはモル分率を用いて次式によって定義される分配係数を表す。
Pi = xi,org/xi,aq (2)
(1)式の左辺は溶質分子と溶媒分子の相互作用の自由エネルギーのみを含んでいる量であって、溶質分子の内部自由エネルギーも混合のエントロピーの寄与も含んでいない[7]。水ー有機相間におけるこの自由エネルギーの差は、溶質分子を水相中から有機相中へ移行する際に必要になるエネルギー(1モル当り)を表しており、無限希釈状態における分配係数の値から(1)式によって決定できる。
図3に、アルカン、アルケン、アルカジエン、芳香族炭化水素、飽和脂肪酸に対する水ーヘプタン間の移行エネルギーを示した[7]。アルカンについて見ると、水相からヘプタン相への移行エネルギーは炭素数の増大とともに減少している。すなわち、長い炭素鎖をもつアルカンほど水相よりはヘプタン相中でより安定に存在する傾向を示していて、炭素数の増加とともに疎水性が強まることになる。溶質の種類によって疎水性は異なるが、炭素数に対する疎水性の減少の割合(直線の傾き)は驚くほど一定である。表5にy切片と傾きをまとめた。
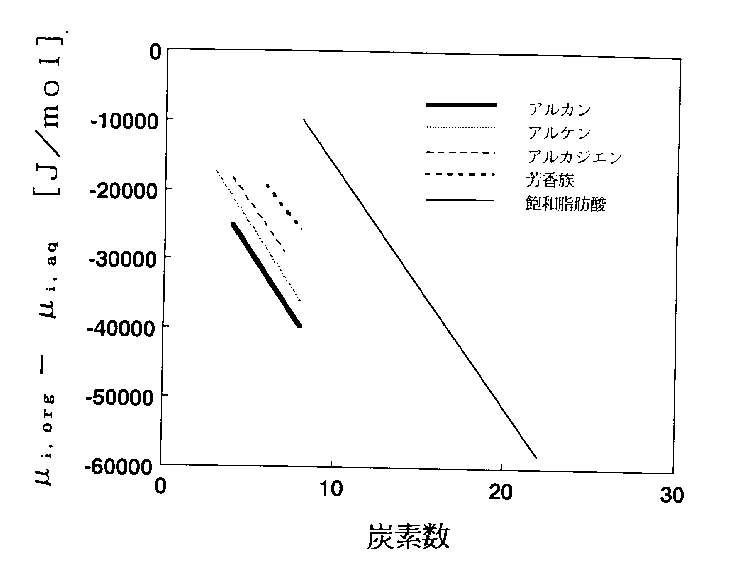
図3 水相からへプタン相への溶質の移行エネルギーと炭素数の関係
表5 炭素数(Cn)の増加に対する水ーヘプタン間の移行エネルギー[7]
μi,org ー μi,aq = A + B Cn
---------------------------------------------------------------
切片A [kJ/mol] 傾きB[KJ/mol]
アルカン -10.2 -3.70
アルケン -6.29 -3.70
アルカジエン -3.78 -3.60
芳香族 -0.63 -3.12
飽和脂肪酸 17.83 -3.45
----------------------------------------------------------------
芳香族に対するA,Bの値は文献[7]の表2.1の値から計算した。
図3の関係はヘプタンを有機溶媒とする場合の結果であるが、ヘプタンに代えて長鎖飽和炭化水素を有機溶媒とする分配係数を用いて図3の関係を描いても実質的に変わらない。例えば、溶媒の炭素数が10増加したとしてもアルカンの移行エネルギーは0.25KJ/molしか違わない[7]。このことは炭化水素の分配においては水中の純炭化水素の溶解度の測定値から移行エネルギーを求めても図3の関係には実質的な変化が現れないことを意味している。実際に、図3の炭化水素に対する関係には川崎[8]が整理したMacAuliffe[9]による炭化水素の水中への溶解度の測定値が用いられている。さらに、溶媒を飽和炭化水素からベンゼンに代えても移行エネルギーは大きくは違わない。例えば、水ーヘキサン間のエチレンの移行エネルギーに比べて水ーベンゼン間のそれは0.1KJ/mol異なるのみである。これらのことは、水相における溶質ー溶媒間相互作用のエネルギーに比べて有機溶媒相におけるその値は小さいことを示していて、水ー有機相間の移行エネルギーは水相において水素結合を歪める効果に支配されていることを暗示している。
