表2 オレフィン分離法[2] ----------------------------------------------- 既存分離法:低温蒸留法、抽出蒸留法 物理吸着法 新規分離法:化学吸着法(Cu(I)担持樹脂の利用) 化学吸収法(Ag(I),Cu(I)水溶液) Ag(I) 錯体型促進拡散利用膜分離法 -----------------------------------------------
第一銅をオレフィン分離に利用する既往の試みを表3[2]にまとめた。第一銅塩の水溶液を用いてガス状オレフィンを吸収分離する方法[4]では第一銅塩が水に溶けずらい欠点がある。アンモニアや塩素イオンを添加して第一銅塩の溶解性を高めることもできるが、これらが銅に優先的に配位するためにオレフィン回収容量の低下をもたらす。フルオロ化合物や二金属塩によって溶解性を高めることも可能であるが、これら自身に分解性があって安定ではない[5,6]。そこで、酸化・還元反応によって第一銅を生成させると同時にオレフィンとπ錯体を形成させる方法が提案された。しかし、金属銅の酸化法は過塩素酸の利用によってアセチレンなどの爆発性化合物の生成を引き起こすので好ましくない。
表3 Cu(I) のオレフィン分離への利用[2]
-----------------------------------------------
方法 欠点
-----------------------------------------------
1.第一銅塩水溶液
(1)CuCl 難溶性、不均一系
(2)NH3,Cl-添加 優先配位による容量低下
(3)(CF3SO4)CuB, 分解性があり不安定
CuAlX4
2.金属銅の酸化
(1) 過塩素酸水溶液 爆発性、不均一系
3.Cu(0)/Cu(I) 接触系 不均一系
(1) 塩酸酸性下でCu(0)/Cu(I) を接触
(2) オレフィン存在下でCu(0)/Cu(II)を接触
------------------------------------------------
塩酸存在下で第二銅と金属銅を接触させる方法は塩化第一銅の生成法として知られている。また、オレフィン存在下で金属銅と第二銅を接触させて互いに酸化・還元してπ錯体を形成する興味ある方法は公開特許[7]において提案されている。この方法はC4留分の吸収分離に対してその有効性が確認されている。液状オレフィンの分離ではメタノールを溶媒とするスチレン/エチルベンゼンの抽出分離に用いた一例のみが明らかにされている[8]。
4.Cu(I)による1、5ヘキサジエンの抽出分離[2]
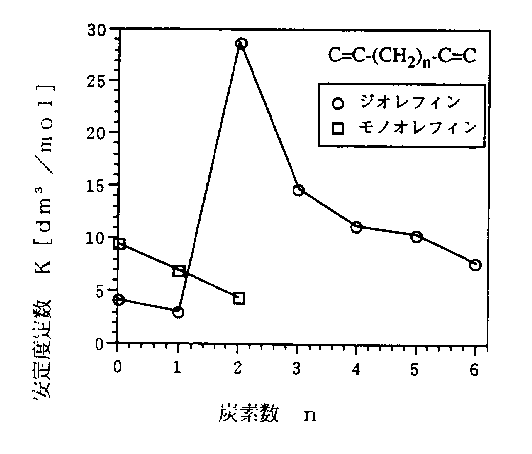
Ag(I)に対して高い錯形成能を示す1,5−ヘキサジエンをモデル不飽和化合物として金属銅/第二銅水溶液系を抽出分離剤に用いる可能性を検討した。
内径70mmの撹拌槽に1M-Cu(NO3)2を100 dm3と、液状炭化水素混合物[50dm3,1,5-ヘキサジエン(10wt%)+1-ヘキセン(15wt%)+シクロヘキセン(20wt%)+トルエン(15wt%)+n- ヘプタン(40wt%)]および金属銅粉末(水溶液中で1mol/dm3)を加えて、6枚平羽根タービン型翼で撹拌した。炭化水素相をガスクロ分析して不飽和化合物の減少量を求めて抽出量を決定した。
4.1 観察結果と抽出機構[2]
Cu(NO3)2は水に溶けてCu(II)イオンの青色を呈するが、オレフィンと反応してCu(I)- オレフィンπ錯体を形成すると水相はCu(I) イオンの緑色を呈する。特に、撹拌翼先端近傍では強い緑色の流体塊が見られた。
撹拌前の銅粉末(平均径は約0.2mm)は油水界面に多くが堆積していた。撹拌停止後の合一界面の移動方向が下向きであることから撹拌中の分散の型はO/W型であることがわかる。
観察結果から図2のような抽出機構が考えられる。オレフィンは油相から水相に分配する。水相の界面近傍で金属銅とCu(II)が接触して不安定なCu(I) が生成する。攪拌翼の先端領域では流体の乱れが強いのでCu(I) の生成速度が高く、緑色を呈する。このCu(I) の一部にオレフィンが配位して安定な錯体が形成される。錯体は水溶液を緑色に変える。
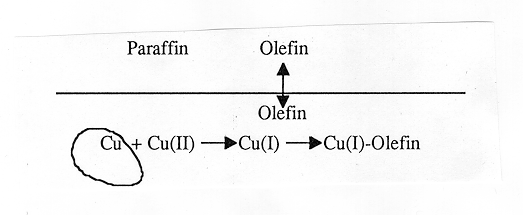
図2 Cu(0)/Cu(II)接触系におけるオレフィンの抽出機構
4.2 抽出速度[2]
図3に、1,5ヘキサジエンの抽出率の経時変化に及ぼす撹拌速度の影響を示す。この抽出系は銅粉末を含む不均一反応系であるので反応成分や錯体の拡散が抽出速度に強く影響することを示している。この点はCu(0)/Cu(II)接触抽出法の欠点として挙げられる。
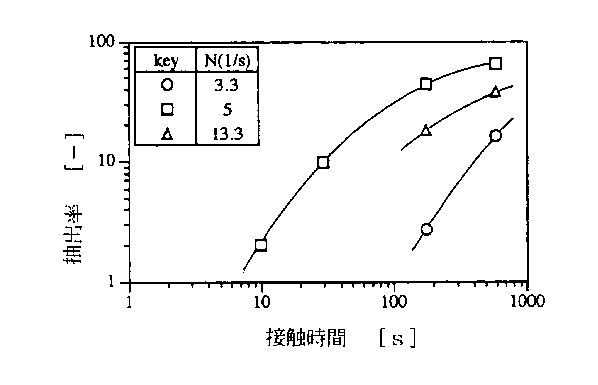
図3 1、5ヘキサジエンの抽出率の経時変化に及ぼす撹拌速度の影響[2]
図4に1、5ヘキサジエンと1−ヘキセンの抽出率の経時変化を比較した。図4にはAgNO3 水溶液を用いた場合の抽出曲線も示してあるが、この場合には均一系であるから拡散の抵抗が小さいので抽出速度は極めて速い。
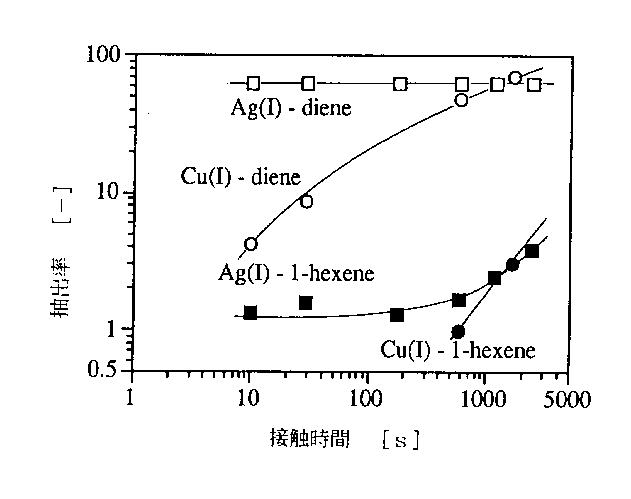
図4 Cu(0)/Cu(II)接触抽出系と硝酸銀水溶液によるオレフィンの抽出率の経時変化[2]
4.3 平衡抽出量[2]
図4のCu(0)/Cu(II)抽出系の結果では抽出平衡には到達していないが、十分に接触せるとAg(I)錯体に比べて平衡抽出量が高くなる傾向を示している。この結果はAg(I)に比べてCu(I)の方が錯形成定数は大きいという一般的傾向[1]に合致している。
図4をみると、Cu(I)においてもAg(I)と同様に、1、5ヘキサジエンの方が1−ヘキセンより平衡抽出量は著しく大きいので、Cu(I)−1、5ヘキサジエンのキレートを形成している可能性が高い。実際に、Cu(I)と1,5ヘキサジエンの結合比率は1:1であることが明らかにされている[9]。トルエンなど他の成分については分析精度内で抽出された兆候は見られなかった。
5.乳化液膜分離法への応用
Cu(I)イオンを含むo/w/o乳化液膜法によって1,5−ヘキサジエンを分離すると想定して、既存の乳化液膜透過データに認められる関係から抽出速度を推定してみる。
Katoら[10]は、既往の報告にある乳化液膜透過データを用いて総括透過容量係数Kiaを求め、拡散律速の状態であればKiaと分配比Diの間に次式の相関関係が成り立つことを見いだしている。
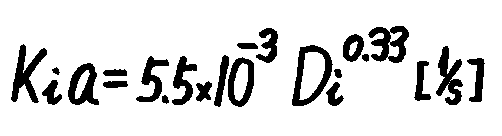
この関係を図5に示す。一方、Cu(0)/1M-Cu(NO3)2系によって1、5ヘキサジエンを抽出する際の分配比は0.3 程度であるから[9]、図5上で(1)式を満たす乳化液膜透過データと比べると、D2EHPAなどによる汲み上げ効果を利用するアミノ酸と同じ程度の透過速度を示すと予想される。ただし、十分に反応速度を高めて均一反応系における拡散律速状態が実現されると仮定している。なお、(1)式の関係は分散の型(w/o/w,o/w/o)に依存せず、高い透過速度を実現する操作条件であって拡散律速状態にあれば±50%の精度内で認められる.また、中空糸モジュール[11]に比べても乳化液膜の容量係数は高く、エマルション滴径/内部液滴径の比を1に近づけることによって分離係数をたかめられる[12,13]ことが示されている。
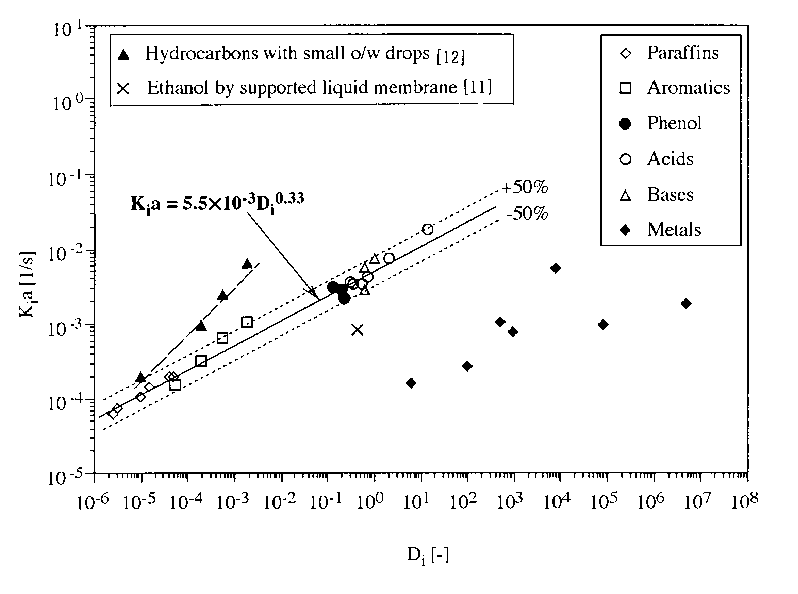
図5 乳化液膜法の総括透過容量係数と分配比の関係[10]
6.おわりに
C4オレフィンの吸収分離において有効性が確認されている金属銅/第二銅溶液接触分離系を液状オレフィンの抽出分離に利用するために、一層検討を進める必要があるものと考えられる。この方法は金属銅を含有する不均一反応系という欠点はあるが、廉価でπ錯体形成能が高いという銅の特長を活用するできるものと期待される。 一方、反応性の高い銅を用いることによる不利益についても検討を進めなければならない。すなわち、抽出操作によるオレフィンの変質について調べ、実際に逆抽出が可能であることも確認しなければならない。
引用文献
1) Hartley,F.H.: Chem.Reviews, 73,163(1973)
2) 加藤 覚,ケミカルエンジニアリング,40,27(1995).
3) Eldridge,H.B., IEC.Res.,32,2208(1993)
4) Gilliland et al., J.A.C.S.,63,2088(1941)
5) 特開、昭51-26806
6) 特公、昭48-35041
7) 特開、昭50-18425
8) 特開、昭57-58633
9) Kato,S.,K.Nakano,H.Noritomi,K.Nagahama:Solv.Ext.Res.Dev.,Japan,3,117(1996).
10)Kato,S.,K.Nakano,H.Noritomi,K.Nagahama:Solv.Ext.Res.Dev.,Japan, in press.
11)Vatai,G.,M.N.Tekic:Sep.Sci.Tech.,26,1005(1991).
12)Kato,S.,J.Kawasaki,J.Chem.Eng.Japan,20,140(1987).
13)Egashira,R.H.Tanno,S.Kato,J.Kawasaki,J.Chem.Eng.Japan,28,38(1995).
表3 Cu(I) のオレフィン分離への利用[2] ----------------------------------------------- 方法 欠点 ----------------------------------------------- 1.第一銅塩水溶液 (1)CuCl 難溶性、不均一系 (2)NH3,Cl-添加 優先配位による容量低下 (3)(CF3SO4)CuB, 分解性があり不安定 CuAlX4 2.金属銅の酸化 (1) 過塩素酸水溶液 爆発性、不均一系 3.Cu(0)/Cu(I) 接触系 不均一系 (1) 塩酸酸性下でCu(0)/Cu(I) を接触 (2) オレフィン存在下でCu(0)/Cu(II)を接触 ------------------------------------------------
4.Cu(I)による1、5ヘキサジエンの抽出分離[2]
Ag(I)に対して高い錯形成能を示す1,5−ヘキサジエンをモデル不飽和化合物として金属銅/第二銅水溶液系を抽出分離剤に用いる可能性を検討した。
内径70mmの撹拌槽に1M-Cu(NO3)2を100 dm3と、液状炭化水素混合物[50dm3,1,5-ヘキサジエン(10wt%)+1-ヘキセン(15wt%)+シクロヘキセン(20wt%)+トルエン(15wt%)+n- ヘプタン(40wt%)]および金属銅粉末(水溶液中で1mol/dm3)を加えて、6枚平羽根タービン型翼で撹拌した。炭化水素相をガスクロ分析して不飽和化合物の減少量を求めて抽出量を決定した。
4.1 観察結果と抽出機構[2]
Cu(NO3)2は水に溶けてCu(II)イオンの青色を呈するが、オレフィンと反応してCu(I)- オレフィンπ錯体を形成すると水相はCu(I) イオンの緑色を呈する。特に、撹拌翼先端近傍では強い緑色の流体塊が見られた。
撹拌前の銅粉末(平均径は約0.2mm)は油水界面に多くが堆積していた。撹拌停止後の合一界面の移動方向が下向きであることから撹拌中の分散の型はO/W型であることがわかる。
観察結果から図2のような抽出機構が考えられる。オレフィンは油相から水相に分配する。水相の界面近傍で金属銅とCu(II)が接触して不安定なCu(I) が生成する。攪拌翼の先端領域では流体の乱れが強いのでCu(I) の生成速度が高く、緑色を呈する。このCu(I) の一部にオレフィンが配位して安定な錯体が形成される。錯体は水溶液を緑色に変える。

図2 Cu(0)/Cu(II)接触系におけるオレフィンの抽出機構
4.2 抽出速度[2]
図3に、1,5ヘキサジエンの抽出率の経時変化に及ぼす撹拌速度の影響を示す。この抽出系は銅粉末を含む不均一反応系であるので反応成分や錯体の拡散が抽出速度に強く影響することを示している。この点はCu(0)/Cu(II)接触抽出法の欠点として挙げられる。

図3 1、5ヘキサジエンの抽出率の経時変化に及ぼす撹拌速度の影響[2]
図4に1、5ヘキサジエンと1−ヘキセンの抽出率の経時変化を比較した。図4にはAgNO3 水溶液を用いた場合の抽出曲線も示してあるが、この場合には均一系であるから拡散の抵抗が小さいので抽出速度は極めて速い。

図4 Cu(0)/Cu(II)接触抽出系と硝酸銀水溶液によるオレフィンの抽出率の経時変化[2]
4.3 平衡抽出量[2]
図4のCu(0)/Cu(II)抽出系の結果では抽出平衡には到達していないが、十分に接触せるとAg(I)錯体に比べて平衡抽出量が高くなる傾向を示している。この結果はAg(I)に比べてCu(I)の方が錯形成定数は大きいという一般的傾向[1]に合致している。
図4をみると、Cu(I)においてもAg(I)と同様に、1、5ヘキサジエンの方が1−ヘキセンより平衡抽出量は著しく大きいので、Cu(I)−1、5ヘキサジエンのキレートを形成している可能性が高い。実際に、Cu(I)と1,5ヘキサジエンの結合比率は1:1であることが明らかにされている[9]。トルエンなど他の成分については分析精度内で抽出された兆候は見られなかった。
5.乳化液膜分離法への応用
Cu(I)イオンを含むo/w/o乳化液膜法によって1,5−ヘキサジエンを分離すると想定して、既存の乳化液膜透過データに認められる関係から抽出速度を推定してみる。
Katoら[10]は、既往の報告にある乳化液膜透過データを用いて総括透過容量係数Kiaを求め、拡散律速の状態であればKiaと分配比Diの間に次式の相関関係が成り立つことを見いだしている。
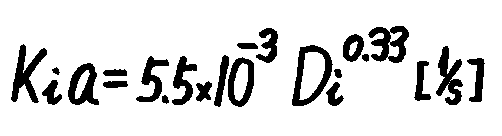
この関係を図5に示す。一方、Cu(0)/1M-Cu(NO3)2系によって1、5ヘキサジエンを抽出する際の分配比は0.3 程度であるから[9]、図5上で(1)式を満たす乳化液膜透過データと比べると、D2EHPAなどによる汲み上げ効果を利用するアミノ酸と同じ程度の透過速度を示すと予想される。ただし、十分に反応速度を高めて均一反応系における拡散律速状態が実現されると仮定している。なお、(1)式の関係は分散の型(w/o/w,o/w/o)に依存せず、高い透過速度を実現する操作条件であって拡散律速状態にあれば±50%の精度内で認められる.また、中空糸モジュール[11]に比べても乳化液膜の容量係数は高く、エマルション滴径/内部液滴径の比を1に近づけることによって分離係数をたかめられる[12,13]ことが示されている。

図5 乳化液膜法の総括透過容量係数と分配比の関係[10]
6.おわりに
C4オレフィンの吸収分離において有効性が確認されている金属銅/第二銅溶液接触分離系を液状オレフィンの抽出分離に利用するために、一層検討を進める必要があるものと考えられる。この方法は金属銅を含有する不均一反応系という欠点はあるが、廉価でπ錯体形成能が高いという銅の特長を活用するできるものと期待される。 一方、反応性の高い銅を用いることによる不利益についても検討を進めなければならない。すなわち、抽出操作によるオレフィンの変質について調べ、実際に逆抽出が可能であることも確認しなければならない。
引用文献
1) Hartley,F.H.: Chem.Reviews, 73,163(1973)
2) 加藤 覚,ケミカルエンジニアリング,40,27(1995).
3) Eldridge,H.B., IEC.Res.,32,2208(1993)
4) Gilliland et al., J.A.C.S.,63,2088(1941)
5) 特開、昭51-26806
6) 特公、昭48-35041
7) 特開、昭50-18425
8) 特開、昭57-58633
9) Kato,S.,K.Nakano,H.Noritomi,K.Nagahama:Solv.Ext.Res.Dev.,Japan,3,117(1996).
10)Kato,S.,K.Nakano,H.Noritomi,K.Nagahama:Solv.Ext.Res.Dev.,Japan, in press.
11)Vatai,G.,M.N.Tekic:Sep.Sci.Tech.,26,1005(1991).
12)Kato,S.,J.Kawasaki,J.Chem.Eng.Japan,20,140(1987).
13)Egashira,R.H.Tanno,S.Kato,J.Kawasaki,J.Chem.Eng.Japan,28,38(1995).
撹拌前の銅粉末(平均径は約0.2mm)は油水界面に多くが堆積していた。撹拌停止後の合一界面の移動方向が下向きであることから撹拌中の分散の型はO/W型であることがわかる。
観察結果から図2のような抽出機構が考えられる。オレフィンは油相から水相に分配する。水相の界面近傍で金属銅とCu(II)が接触して不安定なCu(I) が生成する。攪拌翼の先端領域では流体の乱れが強いのでCu(I) の生成速度が高く、緑色を呈する。このCu(I) の一部にオレフィンが配位して安定な錯体が形成される。錯体は水溶液を緑色に変える。

図2 Cu(0)/Cu(II)接触系におけるオレフィンの抽出機構
4.2 抽出速度[2]
図3に、1,5ヘキサジエンの抽出率の経時変化に及ぼす撹拌速度の影響を示す。この抽出系は銅粉末を含む不均一反応系であるので反応成分や錯体の拡散が抽出速度に強く影響することを示している。この点はCu(0)/Cu(II)接触抽出法の欠点として挙げられる。
図3 1、5ヘキサジエンの抽出率の経時変化に及ぼす撹拌速度の影響[2]
図4に1、5ヘキサジエンと1−ヘキセンの抽出率の経時変化を比較した。図4にはAgNO3 水溶液を用いた場合の抽出曲線も示してあるが、この場合には均一系であるから拡散の抵抗が小さいので抽出速度は極めて速い。

図4 Cu(0)/Cu(II)接触抽出系と硝酸銀水溶液によるオレフィンの抽出率の経時変化[2]
4.3 平衡抽出量[2]
図4のCu(0)/Cu(II)抽出系の結果では抽出平衡には到達していないが、十分に接触せるとAg(I)錯体に比べて平衡抽出量が高くなる傾向を示している。この結果はAg(I)に比べてCu(I)の方が錯形成定数は大きいという一般的傾向[1]に合致している。図4をみると、Cu(I)においてもAg(I)と同様に、1、5ヘキサジエンの方が1−ヘキセンより平衡抽出量は著しく大きいので、Cu(I)−1、5ヘキサジエンのキレートを形成している可能性が高い。実際に、Cu(I)と1,5ヘキサジエンの結合比率は1:1であることが明らかにされている[9]。トルエンなど他の成分については分析精度内で抽出された兆候は見られなかった。
5.乳化液膜分離法への応用
Cu(I)イオンを含むo/w/o乳化液膜法によって1,5−ヘキサジエンを分離すると想定して、既存の乳化液膜透過データに認められる関係から抽出速度を推定してみる。Katoら[10]は、既往の報告にある乳化液膜透過データを用いて総括透過容量係数Kiaを求め、拡散律速の状態であればKiaと分配比Diの間に次式の相関関係が成り立つことを見いだしている。
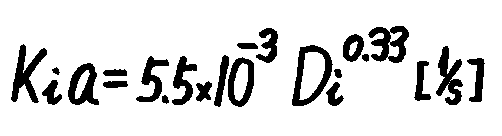
この関係を図5に示す。一方、Cu(0)/1M-Cu(NO3)2系によって1、5ヘキサジエンを抽出する際の分配比は0.3 程度であるから[9]、図5上で(1)式を満たす乳化液膜透過データと比べると、D2EHPAなどによる汲み上げ効果を利用するアミノ酸と同じ程度の透過速度を示すと予想される。ただし、十分に反応速度を高めて均一反応系における拡散律速状態が実現されると仮定している。なお、(1)式の関係は分散の型(w/o/w,o/w/o)に依存せず、高い透過速度を実現する操作条件であって拡散律速状態にあれば±50%の精度内で認められる.また、中空糸モジュール[11]に比べても乳化液膜の容量係数は高く、エマルション滴径/内部液滴径の比を1に近づけることによって分離係数をたかめられる[12,13]ことが示されている。

図5 乳化液膜法の総括透過容量係数と分配比の関係[10]