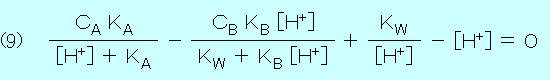
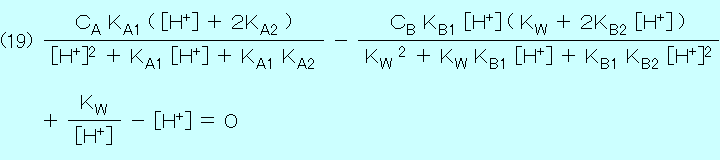
| コ マ ン ド ボ タ ン | 内 容 の 説 明 |
| Ba(OH)2,Ca(OH)2,NaOH,NH4OH, 硫酸,シュウ酸,塩酸,酢酸 | 酸・塩基は16種類の組み合わせが可能です. |
| 塩基滴下 ⇒ 酸滴下 ⇒ | クリックするたびに滴下試薬が切り替わります. |
| メチルオレンジMO ⇒ ブロモフェノールブルーBPB ⇒ ブロモクレゾールグリーンBCG ⇒ ブロモチモールブルーBTB ⇒ ブロモチモールブルーBTB ⇒ フェノールレッドPR ⇒ チモールブルーTB ⇒ フェノールフタレインPP ⇒ | クリックするたびに指示薬が切り替わります. pH指示薬の変色域,色見本とRGB値(表1) |
| 数値読込 | 数値を入力したら,最後にクリックします. または入力ごとに[Enter]を押します. |
| 開始 | 滴定曲線を最初から描きます. |
| 一時停止 ⇒ 再開 ⇒ | クリックするたびに命令が切り替わります. |
| 繰り返し ⇒ 目盛付近手動 ⇒ 当量付近手動 ⇒ 最後停止 ⇒ | クリックするたびに実行モードが切り替わります. |
| 曲線記憶 ⇒ 曲線消去 ⇒ | 任意の位置で6本まで記憶できます. |
| テキストボックス | 内 容 の 説 明 |
| 塩基濃度,横軸目盛,酸の濃度, 試料体積,見掛けの溶解度積, 縦軸の最大濃度 | 数値を変更するには,TextBox に入力するたびに [Enter] キーを押すか,最後にまとめて数値読込をクリックします. |
| チェックボックス | 内 容 の 説 明 |
| 記憶したpH曲線,[H+]と[OH-]を図示するか,計算中の濃度を図示するかを指定します. | |
| 上段の表には計算中の数値を表示します.下段の表には,記憶済みの曲線から表示するものを選択できます. | |
| キーボードの Print Screen キー( COPY キー)を押した後,画像処理プログラム( Photoshop 等)を起動し,新規ファィルにペースト(はりつけ)すれば,画面を取り込めます.編集や保存もできます.その後にワープロ文章(Word,一太郎等)に画像の必要部分を切りばり(カット&ペースト)できます. |
 トップへ
トップへ